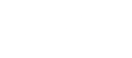456mov,456mov博客
肠道细菌与大脑之间有着千丝万缕的联系456mov,除了影响我们的情绪和食欲456mov,肠道菌群神经退行性疾病的发生过程中也起到了重要作用。现在世界上有4700万人饱受这种疾病的困扰456mov,预计2050年时,每3秒钟就有一个新的病人出现,我们会有超过一亿三千万人受它的困扰。神经退行性疾病中最有名的就是老年痴呆症中的阿尔茨海默病。阿尔兹海默病患者及家属都非常痛苦,患者生活不能自理,记忆逐渐丢失。但是如果从分子水平上认识老年痴呆症,也许会为治疗带来曙光。
神经退行性疾病可能与内源性蛋白质的错误折叠相关,这些蛋白质以类似于朊病毒的方式从身体的一个区域扩散到另一个区域。而细菌可促进人体蛋白质形成淀粉样蛋白,并增强体内炎症反应,从而导致神经变性[1]。

图片来源网络,侵删!
1. 帕金森病与肠道菌群帕金森病(Parkinson’s disease, PD)是一种常见于中老年的神经系统变性疾病,但近年来有年轻化的趋势,临床上以静止性震颤、运动迟缓、肌强直、姿势平衡障碍为主要特征。PD有两大病理特征456mov:一是黑质多巴胺能神经元及其他含色素的神经元大量变性丢失,二是残留的神经元胞质内出现以α-突触核蛋白(α-syn)为主要成分的路易小体。一直以来,我们认为PD只有在环境因素、遗传因素、神经系统老化等因素的共同作用下才会发病,但是现在越来越多的研究表明,PD与肠道菌群之间有着紧密的联系。而脑-肠轴可能就是两者之间的纽带。
1.1 肠道病变早于大脑病变
许多PD患者出现帕金森症状之前先出现了胃肠道症状,如便秘。所以有许多患者先到消化科就诊,然后并没有发现大的问题,等到病变进展到大脑出现运动症状时,患者才到神经科就诊。脑-肠轴的失调可能是它的主要原因,这提示我们PD的病理过程是从肠道扩散至大脑的[2-3]。研究表明,在PD的早期,肠道神经系统就已经发生病变了,它甚至比中枢神经系统先受累[3-4]。Hawkes等人[5]在2007年提出了双击假说,认为α-syn通过两种不同的途径传播到中脑:(1)通过鼻腔,从嗅球到颞叶; (2)通过吞咽唾液中的鼻腔分泌物,然后经肠道神经系统传播。2014年,这个传播过程在小鼠身上得到了验证 [6]。
另外,临床和病理两方面证据也都表明神经系统退变时会伴有胃肠道症状[7],有医生评估了PD患者胃肠道症状发生的比例,流涎、吞咽困难、恶心、便秘、大便功能紊乱分别占了70%、52%、24%、29%、66%,而且只有PD活动度和病程与胃肠道症状相关,患者的年龄、性别、抗帕金森治疗、锻炼、摄入膳食纤维均与胃肠道症状无关[8]。
胃排空障碍是PD的一个重要症状,它可能影响药物药代动力学,导致左旋多巴的吸收下降从而加重运动症状的波动[9]。此外,溃疡病和幽门螺杆菌感染也与PD有关[10],这也可以解释为什么有些PD患者同时患有消化性溃疡或炎症性肠病。
便秘是PD最为突出的胃肠功能障碍,它像是PD的前驱症状或者早期表现[11]。不管是治疗还是未治疗的受试者,甚至在没有症状性便秘的患者中,食物残渣通过结肠的时间都增加了[12]。一项回顾性分析研究了排便频率与PD风险之间的关系,发现不经常排便的人患PD的风险更高 [13] 。而来自芬兰的一项研究称,PD患者的便秘不只是单纯的便秘,可能是因为患有结肠功能障碍,他们发现具有肠易激综合征样症状的PD患者中普氏菌 (简称P菌)较少,这说明脑-肠-菌群轴可能与帕金森患者的胃肠功能障碍有关[14]。
图片来源网络,侵删!
1.2 菌群与血脑屏障
在无菌动物模型中发现,肠道菌群可以使血脑屏障的通透性改变[15],α-syn就可以通过血脑屏障双向运输出入大脑。血脑屏障是中枢神经系统的重要保护机制,负责严格控制进出大脑的分子。但随着年龄的增长,血脑屏障的功能下降,大量病原体、免疫细胞及其产物(如α-syn)更容易进入大脑,导致大脑产生病变[16-17]。病原菌产生的脂多糖和促炎因子促进了炎症反应,脂多糖诱导的炎症可以破坏血脑屏障的通透性增加大脑对α-syn的摄取[18]。在PD的动物模型中,外周诱导的炎症会诱导小胶质细胞损害多巴胺能神经元[19],与慢性胃肠疾病相关的促炎因子会诱发脑部炎症和多巴胺能神经元的死亡,最终可能导致PD的发生[20-21]。
1.3 遗传因素
除了上面讲到的多种影响因素,遗传因素在脑-肠轴与肠道炎症之间的相互作用中也起到重要作用。现已证明载脂蛋白ApoE的ε4等位基因可增加PD等突触核蛋白病中痴呆的风险[22],与克罗恩病相关的CARD15基因也在PD患者中过表达,这个现象也说明胃肠道炎症能促进PD的发病[23]。那么有胃肠疾病家族史的个体,不仅胃肠疾病的患病风险增加,PD的患病风险也增加了。
1.4 菌群变化
PD患者的脑-肠轴的改变在整个发病过程中起到了重要作用,那么这些菌群到底有什么样的变化呢?多项研究均表明半数以上的PD患者小肠细菌呈现过度生长的情况,发生率从54%到67%不等。
上面提到了芬兰的学者发现PD患者肠道中的P菌比正常人丰度低(类型和数量少)[14, 24],而P菌是人体肠道的共生菌,它们能产生黏蛋白和短链脂肪酸[25],当它们减少时,肠道通透性增加,肠道细菌抗原和内毒素就有更多机会侵入机体,这样会引起α-syn过度表达,甚至使其发生错误折叠[26]。α-syn过多的另一种原因可能是短链脂肪酸通过调整基因的表达来影响α-syn的清除[27]。然后这些不应该出现的α-syn沿着前文提到的两种途径转移到脑内,导致PD。芬兰学者还对不同表型的PD患者进行了对比,发现以姿势步态异常为主的患者比以震颤为主的PD患者肠道中肠杆菌要多,具体机制尚不清楚 [24]。
纵观这些研究,PD的两大病理特征几乎均可因肠道菌群的改变而形成,因此我们有理由相信肠道菌群是影响PD发生发展的重要因素,或许这能成为治疗PD的一个方法。
图片来源网络,侵删!
2. 阿尔兹海默病与肠道菌群阿尔兹海默病(Alzheimer disease, AD)是老年期最常见的痴呆类型,约占老年期痴呆的50~70%。AD发生于老年和老年前期,是一种以进行性认知功能障碍和行为损害为特征的中枢神经系统退行性病变。主要表现为记忆障碍、失语、失用、失认、视空间能力损害、抽象思维和计算力损害、人格和行为改变等。有关AD的发病机制有多种学说,影响较大的有β-淀粉样蛋白(β-amyloid, Aβ)瀑布理论和tau蛋白学说,前者认为Aβ的生成和清除失衡是导致神经元变性和痴呆的起始事件,后者认为过度磷酸化的tau蛋白使神经原纤维缠结(NFT)形成,进而破坏了神经元和突触的正常功能[28]。总之就是不好的蛋白沉积在大脑,使得神经元不能正常工作了。
肠道菌群在AD的发病中的作用与在PD中相似,均始于脑-肠轴失调。肠道菌群会产生大量的脂多糖、淀粉样蛋白和各种微生物分泌物,在健康状态下,机体也暴露于大量的脂多糖和淀粉样蛋白[29]。这种暴露可能对健康有害,特别是当机体衰老时,胃肠粘膜和血脑屏障结构发生变化,渗透性增加,这些有害物质会更容易到达大脑,引起AD、PD等疾病[29-31]。我国学者进行了一项有趣的研究,他们将小鼠暴露与慢性噪声中,发现小鼠肠道微生物群发生改变,并加速了与年龄相关的神经化学和炎症失调,促进了小鼠脑内AD样改变(认知障碍和Aβ积累) [32]。这不禁让我想到一个问题,当我们长期置于吵闹的环境中时,会增加患AD的风险吗?我们可以期待后续的研究来告诉我们答案。

图片来源网络,侵删!
肠道菌群也可产生一系列神经活性分子(如血清素,犬尿氨酸,褪黑激素,GABA,儿茶酚胺,组胺和乙酰胆碱)[33-34]及短链脂肪酸(包括乙酸盐,丁酸盐和丙酸盐),从而影响脑的功能。乙酸盐可以穿过血脑屏障,向大脑发出饱足感,丁酸盐可导致运动性增加,丙酸盐会降低运动性并增加分泌物。此外,它还能影响小胶质细胞并降低血脑屏障的渗透性[35-37]。丁酸盐是一种多功能分子,可保护神经并改善脑健康。在小鼠中的创伤性脑损伤模型中,向腹膜内注射丁酸钠能减弱神经元缺陷和脑水肿,并恢复了血脑屏障的功能[38]。在小鼠的AD模型中,丁酸钠对学习和记忆有显著改善,并使得学习相关的基因表达增加[39-40]。
对肠道菌群的研究终将是要为人类健康服务的。现在肠道菌群已经开始应用于临床了。如粪便微生物群移植现在越来越多地用于治疗复发性梭状芽孢杆菌机会性感染的患者,取得了非常好的临床效果[41]。此外,小鼠之间的粪便移植能够转移小鼠不同品系之间的行为特征[42],比如一只性格暴躁攻击性强的小鼠和一只性格温顺安静的小鼠,将它们两的肠道菌群互换移植,能使它们两的性格互换。可以预期,将健康人群中的粪便微生物群移植到AD患者的肠道中可以帮助恢复正常肠道菌群,并减少原有菌群对肠道和脑功能的负面影响。
图片来源网络,侵删!
既然PD和AD等神经系统疾病可能起源于肠道,那么对于高危人群使用食物调节肠道菌群应该是可以起到一定的预防作用的。
无论是PD、AD等神经退行性疾病,还是癫痫这一类神经元异常放电的综合征,目前都是以药物治疗为主,有适应症者可进行手术,如帕金森患者可采用DBS(脑深部刺激)手术。但是药物治疗的效果有限,而手术的费用较高,且有些患者因身体情况无法进行手术。近年来对肠道菌群的研究为我们提供了一种全新的治疗思路,在这个比我们身体细胞总数还多的微生物群体里隐藏着诸多疾病的密码,疾病的表现和菌群变化之间的高度相关性告诉我们这绝不是偶然,来自全球各地的同道都在致力发掘其背后的故事,为战胜疾病默默努力着。希望在不久的将来,这些药物很可能像青霉素、格列卫的发明一般惊艳世人,给广大患者带来更高的生活质量。
图片来源于网络,版权归原作者所有,侵删!
【参考文献】
[1] Friedland R, Chapman M. The role of microbial amyloid in neurodegeneration. PLoS Pathog. 2017, 13(12):e1006654
[2] Braak H, de Vos RA, Bohl J, et al. Gastric alpha-synuclein immunoreactive inclusions in Meissner’s and Auerbach’s plexuses in cases staged for Parkinson’s disease-related brain pathology. Neurosci Lett. 2006; 396: 67-72
[3] Lebouvier T, Chaumette T, Paillusson S, et al. The second brain and Parkinson’s disease. Eur J Neurosci. 2009; 30: 735-741
[4] Paillusson S, Clairembault T, Biraud M, et al. Activity-dependent secretion of alpha-synuclein by enteric neurons. J Neurochem. 2013; 125: 512-517
[5] Hawkes CH, Del Tredici K, Braak H. Parkinson’s disease: a dual-hit hypothesis. Neuropathol Appl Neurobiol. 2007; 33: 599-614
[6] Holmqvist S, Chutna O, Bousset L, et al. Direct evidence of Parkinson pathology spread from the gastrointestinal tract to the brain in rats. Acta Neuropathol. 2014; 128: 805-820
[7] Natale G, Pasquali L, Paparelli A, Fornai F. Parallel manifestations of neuropathologies in the enteric and central nervous systems. Neurogastroenterol Motil. 2011; 23: 1056-1065
[8] Edwards LL, Quigley EM, Pfeiffer RF. Gastrointestinal dysfunction in Parkinson’s disease: frequency and pathophysiology. Neurology. 1992; 42: 726-732
[9] Djaldetti R, Baron J, Ziv I, Melamed E. Gastric emptying in Parkinson’s disease: patients with and without response fluctuations. Neurology. 1996; 46: 1051-1054
[10] Alvarez-Arellano L, Maldonado-Bernal C. Helicobacter pylori and neurological diseases: Married by the laws of inflammation. World J Gastrointest Pathophysiol. 2014; 5: 400-404
[11] Pfeiffer RF. Gastrointestinal dysfunction in Parkinson’s disease. Parkinsonism Relat Disord. 2011; 17: 10-15
[12] Sakakibara R, Odaka T, Uchiyama T, et al. Colonic transit time and rectoanal videomanometry in Parkinson’s disease. J Neurol Neurosurg Psychiatry. 2003; 74: 268-272
[13] Abbott RD, Petrovitch H, White LR, et al. Frequency of bowel movements and the future risk of Parkinson’s disease. Neurology. 2001; 57: 456-462
[14] Mertsalmi TH, Aho VTE, Pereira PAB, et al. More than constipation-bowel symptoms in Parkinson’s disease and their connection to gut microbiota. Euro J Neuro. 2017, 24: 1375–1383
[15] Braniste V, Al-Asmakh M, Kowal C, et al. The gut microbiota influences blood-brain barrier permeability in mice. Sci Transl Med. 2014; 6: 263ra158
[16] Sochocka M, Diniz BS, Leszek J. Inflammatory response in the CNS: friend or foe? Mol Neurobiol. 2017; 54:8071–8089
[17] Le Page A, Dupuis G, Frost EH, et al. Role of the peripheral innate immune system in the development of Alzheimer’s disease. Exp Gerontol. 2017; 107:59-66
[18] Sui YT, Bullock KM, Erickson MA, et al. Alpha synuclein is transported into and out of the brain by the bloodbrain barrier. Peptides. 2014; 62:197-202
[19] Bodea LG, Wang Y, Linnartz-Gerlach B, et al. Neurodegeneration by activation of the microglial complement-phagosome pathway. J Neurosci. 2014; 34: 8546-8556
[20] Dobbs RJ, Charlett A, Purkiss AG, et al. Association of circulating TNF-alpha and IL-6 with ageing and parkinsonism. Acta Neurol Scand. 1999; 100: 34-41
[21] Villarán RF, Espinosa-Oliva AM, Sarmiento M, et al. Ulcerative colitis exacerbates lipopolysaccharide-induced damage to the nigral dopaminergic system: potential risk factor in Parkinson’s disease. J Neurochem. 2010; 114: 1687-1700
[22] Tsuang D, Leverenz JB, Lopez OL, et al. APOE ε4 increases risk for dementia in pure synucleinopathies. JAMA Neurol. 2013; 70: 223-228
[23] Bialecka M, Kurzawski M, Klodowska-Duda G, et al. CARD15 variants in patients with sporadic Parkinson’s disease. Neurosci Res. 2007; 57: 473-476
[24] Scheperjans F, Aho V, Pereira PA, et al. Gut microbiota are related to Parkinson’s disease and clinical phenotype. Mov Disord. 2015; 30: 350-358
[25] Arumugam M, Raes J, Pelletier E, et al. Enterotypes of the human gut microbiome. Nature. 2011; 473: 174-180
[26] Forsyth CB, Shannon KM, Kordower JH, et al. Increased intestinal permeability correlates with sigmoid mucosa alphasynuclein staining and endotoxin exposure markers in early Parkinson’s disease. PLoS One. 2011; 6: e28032
[27] Vizcarra JA, Wilson-Perez HE, Espay AJ. The power in numbers: gut microbiota in Parkinson’s disease. Mov Disord. 2015; 30: 296-298
[28] 贾建平, 陈生弟. 神经病学. 北京. 人民卫生出版社, 2013
[29] Zhao Y, Lukiw WJ. Microbiome-generated amyloid and potential impact on amyloidogenesis in Alzheimer’s disease (AD). J Nat Sci. 2015; 1(7):138
[30] Hill JM, Lukiw WJ. Microbial-generated amyloids and Alzheimer’s disease (AD). Front Aging Neurosci. 2015; 7:9
[31] Hammer ND, Wang X, McGuffie BA, et al. Amyloids: friend or foe? J Alzheimers Dis. 2008; 13:407-419
[32] Cui B, Su D, Li W, et al. Effects of chronic noise exposure on the microbiome-gut-brain axis in senescence-accelerated prone mice: implications for Alzheimer. J Neuroinflammation. 2018, 15(1): 190
[33] Barrett E, Ross RP, O’Toole PW, et al. γ-Aminobutyric acid production by culturable bacteria from the human intestine. J Appl Microbiol. 2012; 113:411-417
[34] Lyte M. Probiotics function mechanistically as delivery vehicles for neuroactive compounds: microbial endocrinology in the design and use of probiotics. Bioessays. 2011; 33:574-581
[35] Du X, Wang X, Geng M. Alzheimer’s disease hypothesis and related therapies. Transl Neurodegener. 2018; 7:2
[36] Bienenstock J, Kunze W, Forsythe P. Microbiota and the gut-brain axis. Nutr Rev. 2015; 73(Suppl 1):28-31
[37] Frost G, Sleeth ML, Sahuri-Arisoylu M, et al. The shortchain fatty acid acetate reduces appetite via a central homeostatic mechanism. Nat Commun. 2014; 29(5):3611
[38] Li H, Sun J, Wang F, et al. Sodium butyrate exerts neuroprotective effects by restoring the blood-brain barrier in traumatic brain injury mice. Brain Res. 2016; 1642:70-78
[39] Govindarajan N, Agis-Balboa RC, Walter J, et al. Sodium butyrate improves memory function in an Alzheimer’s disease mouse model when administered at an advanced stage of disease progression. J Alzheimers Dis. 2011; 26: 187-197
[40] Kilgore M, Miller CA, Fass DM, et al. Inhibitors of class 1 histone deacetylases reverse contextual memory deficits in a mouse model of Alzheimer’s disease. Neuropsychopharmacology. 2010; 35:870-880
[41] Rogers GB, Bruce KD. Challenges and opportunities for faecal microbiota transplantation therapy. Epidemiol Infect. 2013; 141: 2235-2242
[42] Collins SM, Kassam Z, Bercik P. The adoptive transfer of behavioral phenotype via the intestinal microbiota: experimental evidence and clinical implications. Curr Opin Microbiol. 2013; 16:240-245
本文 麒麟点评 原创,转载保留链接!网址:http://kylinpackage.com.cn/dianping/9074.html
1.本站遵循行业规范,任何转载的稿件都会明确标注作者和来源;2.本站的原创文章,请转载时务必注明文章作者和来源,不尊重原创的行为我们将追究责任;3.作者投稿可能会经我们编辑修改或补充。